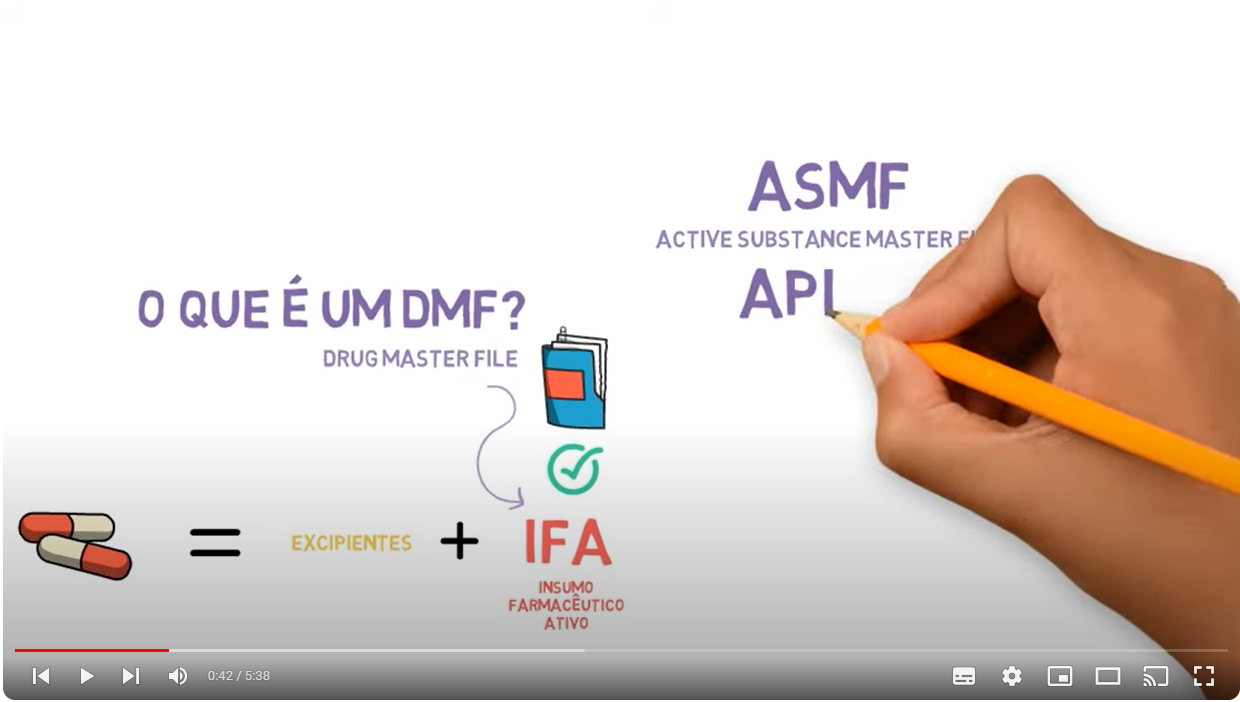
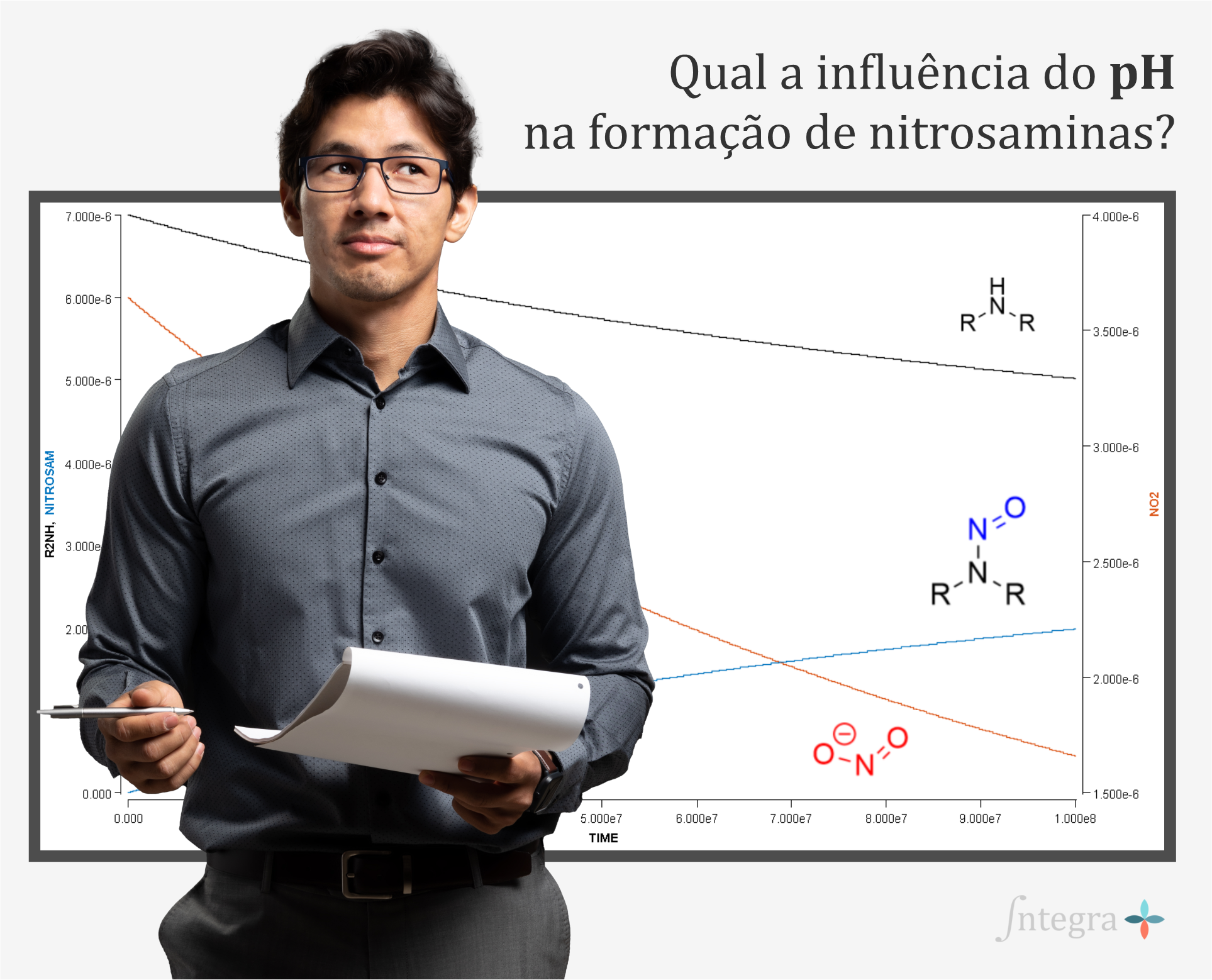
Considerando a química por trás da formação de nitrosaminas, pode-se atribuir alguns fatores que conferem maior ou menor risco de contaminação. Por exemplo, para processos onde é obtida solução aquosa, o pH é considerado o fator mais crítico, entretanto também são relevantes a temperatura, a ordem de adição e a concentração dentro dos componentes da formulação. Para processos onde o pH é ácido, 3 a 4, considera-se que seria a condição ideal para nitrosação com ácido nitroso. Conforme o pH aumenta, a reação de nitrosação torna-se muito menos provável, e se condições de pH> 7 forem utilizadas, o risco de nitrosação de aminas com nitrito residual é considerado insignificante. Entretanto, esta observação pode não ser verdadeira caso o mecanismo de formação da nitrosamina seja outra que não nitrosação. Já os processos de formulação de sólidos apresentam menor risco quando comparados aos processos de líquidos e semi-sólidos, uma vez que a mobilidade molecular e a difusão de reagentes dentro de uma matriz sólida é substancialmente inferior. Desse modo, a baixa disponibilidade das espécies químicas, aminas e agentes nitrosantes, torna menos pronunciado o impacto das variações de pH, temperatura e volume de água. Assim, pode-se inferir que o risco para um produto de dosagem sólida oral é, portanto, muito menor do que para a fase de solução, pois qualquer nitrito provavelmente será menos reativo.